集細胞法、処理法の違いと疑陽性判定細胞像の特徴について
福田正彦
![]() 検討内容1(検体処理法)
検討内容1(検体処理法)
自然尿検体のうちclass分類に関係なく赤血球多数例、好中球多数例、上皮細胞多数例、細胞成分少数例を各50例ずつランダムに抽出し計200例を用い、尿保存液ウリキープ(武藤化学)20ml入った容器に尿30mlを入れ全量50mlとし、4分割してメンブレンフィルター法、Thinlayer法、オートスメア法、引きガラス法の4種の処理法について、塗抹量および細胞成分を中心に検討した。
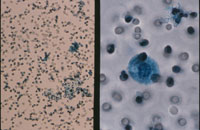
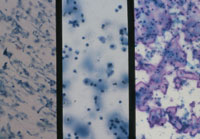
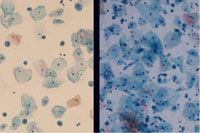
メンブレンフィルター法は、普通のプレパラート上にフィルターを封入するとポアが多数見えて鏡検の妨げになっている(Fig1)。このため白色フィルムを貼った専用のプレパラート使用することでポアを拡散させて見えないようにすることができる。幾分、光の透過性が悪くなるがあまりポアを気にしなくても鏡検できるようになる。利点として集細胞に優れ(Fig2)、赤血球がポアと通過することが多いため鏡検の邪魔にならず(Fig3)、操作が簡便で手技の統一化を図ることが可能などが上げられる。また欠点としてコストが高いことや、フィルター独特のアーチファクト(Fig4)がみられる。
 |
 |
|
|
Fig1
|
Fig.2
|
|
 |
 |
|
|
Fig.3
|
Fig.4
|
 |
 |
|
|
Fig.5
|
Fig.6
|
|
 |
 |
|
|
Fig.7
|
Fig.8
|
引きガラス法は細胞の剥離が問題となり、個々の手技の差が顕著に表れる方法といわれている。そこで沈渣に含まれる水分量がいかに塗抹に影響しているかの確認を試みた。
同一検体を4分割し、遠沈後デカンテーションして倒立状態のまま沈渣を採取したのも(Fig9左)、1分倒立後スピッツを元にもどして沈渣を採取したもの(Fig9右)、3分のもの(Fig10左)、5分のもの(Fig10右)と変えて引きガラス法にて塗抹した。結果として倒立状態のままで塗抹したものと5分倒立後スピッツをもとにもどして塗抹したもので塗抹量が多く、3分、1分と塗抹量が減る結果となった。沈渣が確認できないような検体を倒立状態のままを採取して引きガラス法にて処理した標本でも、引き終わりにわずかであるが異型尿路上皮細胞が観察できる(Fig11)。水分をどれだけ取り除いて塗抹できるかが引きガラス法の塗抹に細胞をのせる決め手となると考える。
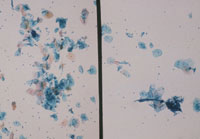 |
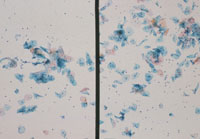 |
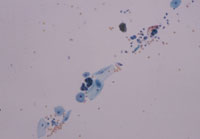 |
|
Fig.9
|
Fig.10
|
Fig.11
|
|
検体処理法の評価(表2)
|
我々の施設において過去3年間に提出された自然尿検体(13186件)の中から検査や治療の影響を受けていない検体に限定し、細胞診の判定がclassIIIa・IIIであった45件について、その細胞所見を再検討した。45件の内訳は、後の組織診にて尿路上皮癌の診断が得られた30件(尿路上皮癌G1:14例、G2:10例、G3:4例、CIS:2例)と後の組織診で尿路上皮癌が確認できていない15件(膀胱炎:11例、過形成:2例、乳頭種:1例、異形成:1例)である。
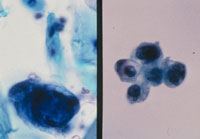
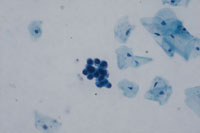
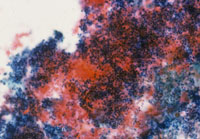
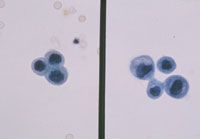
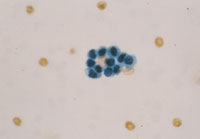
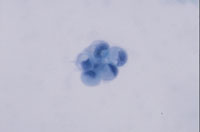
癌例に見られる異型尿路上皮細胞(Fig12)では核の立体的不整、緊満感(言ってみれば細胞質から飛び出さんばかりの核という感じ)があるものの、癌未確認例(Fig13)ではそれが見て取れず、クロマチンが濃染しているものの構造は読み取れない。さらにはN/C比の高い濃染核を有する小型異型細胞(Fig14)はしばしば癌例に見られる所見である。また(Fig15)のように核形不整の著明な核の核膜が細胞膜と接するような核偏在性には注意を払う必要がある。
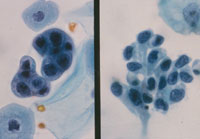 |
 |
|
Fig.12
|
Fig.13
|
 |
 |
|
Fig.14
|
Fig.15
|
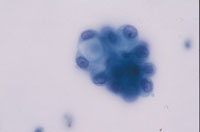
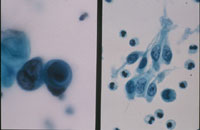
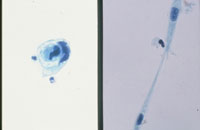
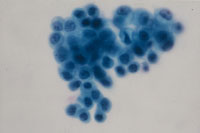
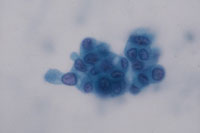
(Fig18)は癌例に、(Fig19)は癌未確認例にみられたpair cellと遊離型細胞である。これらは形だけにとらわれず異型の有無について確認することが必要と考えられた。さらには尿路上皮細胞の細胞質の性状も確認すべきと思われる。細胞質に分化傾向が伺われるかどうかという評価になるが、扁平上皮細胞とは違い、明確に確認できない。しかし癌例では細胞質の性状が不均質になる傾向がみられるものの(Fig20)、非癌例では均質なままである傾向が見られた(Fig21)。
|
Fig.16
|
Fig.17
|
 |
 |
|
Fig.18
|
Fig.19
|
 |
 |
|
Fig.20
|
Fig.21
|